Sifat koligatif larutan merupakan salah satu materi yang pasti akan dipelajari dalam pelajaran kimia. Bahan ini erat kaitannya dengan jenis zat terlarut yang terjadi dalam kehidupan sehari-hari. Ada beberapa hal yang mungkin belum diketahui oleh orang awam mengenai sifat koligatif dalam larutan.
Saat Anda membuat minuman dengan air panas dan gula, tentu Anda tidak akan bisa melihat gula di dalamnya. Ini karena gula telah benar-benar larut dalam air panas. Dua campuran air panas dan gula adalah contoh larutan.
Memahami Sifat Koligatif Larutan
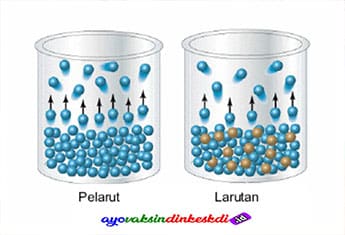
Memahami sifat koligatif larutan adalah sifat yang bergantung pada konsentrasi zat terlarut, bukan pada jenis zat yang dilarutkan. Hukum Roult adalah dasar hukum untuk sifat koligatif. Dalam bahasa latin colligative adalah colligare yang artinya berkumpul bersama.
Properti ini tergantung pada pengaruh kolektif semua partikel. Selain itu, sifat ini sangat tidak bergantung pada keadaan partikel. Semakin banyak zat terlarut dalam suatu larutan, semakin besar sifat koligatifnya.
Definisi lain dari sifat koligatif adalah sifat yang tidak melihat kualitas tetapi kuantitas. Sifat-sifat yang bergantung pada jenis zat terlarut meliputi viskositas dan warna. Ada dua asumsi yang harus dipenuhi sebagai syarat untuk mengatakan solusi dikatakan koligatif.
Asumsi pertama adalah zat terlarut akan sulit mengalami penguapan. Dengan demikian zat terlarut tidak dapat berkontribusi pada uap. Asumsi kedua adalah zat terlarut tidak dapat larut dalam zat padat.
Konsentrasi larutan
Konsentrasi larutan adalah jumlah partikel zat terlarut dalam larutan yang dinyatakan dalam besarnya. Ada tiga macam konsentrasi larutan, yaitu molaritas (M), fraksi mol (X), dan molalitas (m). Berikut review dari ketiga konsentrasi larutan yang ada:
1. Molaritas (M)
Molaritas adalah jumlah atau banyaknya mol suatu zat yang dapat larut dalam 1 liter larutan. Persamaan yang digunakan untuk menghitung molaritas (M) adalah:
Informasi:
M = molaritas (M)
V = volume (L atau mL)
ρ = densitas (gr/mL)
n = mol zat (mol)
Mr = molekul relatif (gr/mol)
% = persen kandungan zat
2. Fraksi Mol (X)
Fraksi mol adalah ukuran rasio jumlah pelarut dengan jumlah mol zat terlarut dengan jumlah mol semua komponen dalam larutan. Terdapat 3 fraksi mol dalam suatu larutan, yaitu fraksi mol pelarut (Xp) dan fraksi mol terlarut (Xt).
Persamaan yang digunakan untuk menghitung fraksi mol (X) adalah:
Informasi:
Xt = fraksi mol zat terlarut
Xp = fraksi mol pelarut
nt = mol terlarut
np = mol pelarut
p = massa pelarut (gr)
3. Molalitas (m)
Molalitas adalah jumlah mol zat terlarut dalam setiap 1000 gram pelarut. Persamaan yang digunakan untuk menghitung molalitas adalah sebagai berikut:
Informasi:
m = molalitas
gr = massa terlarut (gr)
p = massa pelarut (gr)
Mr = molekul relatif (gr/mol)
Klasifikasi Sifat Koligatif Larutan

Sebelumnya telah dijelaskan bahwa sifat koligatif larutan tidak bergantung pada jenis zat terlarut. Sifat ini sangat bergantung pada jumlah partikel atau zat terlarut yang terlarut dalam suatu larutan. Dalam klasifikasinya, sifat koligatif larutan dapat dikategorikan menjadi 4 jenis.
Dimana empat kategori yang dimaksud adalah kenaikan titik didih, penurunan tekanan uap, tekanan osmotik, dan penurunan titik beku. Molekul pelarut dalam sistem pelarut murni akan mempengaruhi titik beku, titik didih, tekanan uap, dan tekanan osmotik.
Berbeda dengan sistem pelarut yang mengandung zat terlarut dan pelarut. Faktanya, zat terlarut akan menghasilkan perubahan dalam empat kategori sifat koligatif larutan.
Misalnya, apa yang terlarut dalam bentuk volatil dapat menyebabkan tekanan uap jenuh suatu larutan menjadi lebih besar daripada tekanan uap pelarutnya. Berbeda dengan zat terlarut yang tidak mudah menguap, dimana zat ini akan lebih diarahkan untuk menurunkan tekanan uap dalam suatu larutan.
Titik didih dan titik beku larutan adalah sifat koligatif larutan disebabkan oleh perubahan tekanan uap. Berikut ini adalah penjelasan lebih rinci dari empat kategori sifat koligatif dalam larutan:
1. Penurunan Tekanan Uap
Pengertian penguapan adalah peristiwa yang terjadi ketika berbagai partikel yang berada di dalam cairan terpisah dari kelompoknya. Cairan akan lebih mudah menguap bila gaya tarik menarik antar molekul suatu larutan lebih lemah.
Sebaliknya, semakin besar tekanan uap jenuh suatu larutan, semakin mudah cairan tersebut menguap. Definisi tekanan uap adalah jumlah atau banyaknya uap yang keluar dari permukaan zat cair.
Uap akan berubah menjadi cairan ketika partikel-partikel yang termasuk dalam cairan tersebut terpisah atau keluar dari kelompoknya. Sedangkan pengertian tekanan uap sendiri adalah tekanan yang ada pada saat kesetimbangan antara jumlah uap menjadi cair dan jumlah partikel zat cair menjadi uap.
Seorang ahli kimia dari Perancis bernama FMRoult pada tahun 1880 menyatakan bahwa dalam proses pelarutan suatu zat terdapat dampak yaitu tekanan uap akan menurun. Persamaan yang menyatakan hukum Roult adalah sebagai berikut:
Jika tekanan uapnya di atas larutan yang bersimbol P, maka akan menjadi:
Kemudian jika komponen larutan terdiri dari zat terlarut dan pelarut, konstanta rumus berikut akan digunakan:
Jadi:
Persamaan yang terbentuk adalah:
Informasi:
Xp = fraksi mol pelarut
Xt = fraksi mol zat terlarut
P = tekanan uap larutan (mmHg)
P° = tekanan uap jenuh dalam pelarut murni (mmHg)
ΔP = penurunan tekanan uap (mmHg)
2. Kenaikan Titik Didih
Titik didih cairan adalah suhu konstan di mana cairan mendidih. Pada suhu tersebut, tekanan udara di sekitarnya akan sama dengan tekanan uap cairan. Ini menghasilkan penguapan bagian cair dari zat tersebut.
Pengukuran titik didih zat cair menggunakan tekanan 1 atmosfer. Pada dasarnya titik didih pelarut murni selalu lebih rendah dari titik didih larutan. Ini karena partikel dalam zat terlarut menghambat penguapan suatu partikel.
Oleh karena itu, penguapan partikel pelarut membutuhkan energi yang jauh lebih besar. Rumus yang digunakan dalam perhitungan kenaikan titik didih:
Informasi:
Tb = titik didih dalam larutan
Tb° = titik didih pelarut
m = molalitas larutan (molal)
Kb = konstanta kenaikan titik didih molar
ΔTb = kenaikan titik didih
3. Depresi Titik Beku
Titik beku larutan adalah suhu di mana tekanan uap cairan sama dengan tekanan uap padatan. Dengan kata lain, titik beku dapat dikatakan saat cairan membeku.
Titik beku normal adalah suhu ketika suatu zat membeku atau meleleh dalam kondisi normal atau pada tekanan 1 atm. Depresi titik beku terjadi ketika zat terlarut ditambahkan ke pelarut murni.
Hal ini karena molekul dalam pelarut tidak mudah berubah menjadi cair. Persamaan yang digunakan untuk menghitung penurunan titik beku adalah sebagai berikut:
Informasi:
Tf = titik beku larutan
Tf° = titik beku pelarut
m = molalitas larutan (molal)
Kf = konstanta penurunan titik beku pada molal
ΔTf = penurunan titik beku
4. Tekanan osmotik
Osmosis adalah peristiwa dimana terjadi proses perpindahan molekul terlarut di antara larutan encer. Di mana transfer terjadi dalam larutan yang kurang pekat ke larutan yang lebih pekat.
Pada peristiwa osmosis akan berlangsung sampai terjadi kesetimbangan atau kedua larutan isotonik telah tercapai. Hal yang menandai larutan osmotik adalah perubahan volume yang terjadi akan berhenti.
Persamaan yang digunakan untuk menghitung tekanan osmotik:
Informasi:
П = tekanan osmotik (atm)
R = Konstanta gas (0,082 atm L/mol K)
M = molaritas (mol/L)
N = mol terlarut (mol)
T = suhu (k)
v = volume larutan (mL atau L)
Manfaat Sifat Koligatif dalam Kehidupan Sehari-hari

Pada dasarnya sifat koligatif larutan dapat Anda temukan dalam kehidupan sehari-hari. Hal ini karena tidak dapat dipungkiri bahwa sifat koligatif memiliki manfaat dalam kehidupan sehari-hari. Berikut adalah beberapa manfaat yang dimiliki oleh sifat koligatif dalam suatu larutan:
1. Penurunan Tekanan Uap
Manfaat menurunkan tekanan uap dalam kehidupan nyata meliputi:
- Dapatkan benzena murni dengan memisahkan campuran dengan distilasi bertingkat. Dalam hal ini menggunakan prinsip perbedaan tekanan uap antara zat terlarut dan pelarut.
- Digunakan di kolam renang sehingga saat orang berenang bisa mengapung. Hal ini dikarenakan kandungan garam pada tambak apung lebih tinggi dari kandungan garam rata-rata dalam suatu larutan. dengan demikian air akan sulit mengalami penguapan karena kandungan garam yang menyebabkan berkurangnya uap pelarut.
2. Kenaikan Titik Didih
Dalam kehidupan sehari-hari, kenaikan titik didih memiliki manfaat sebagai berikut:
- Pada proses distilasi yang merupakan proses pemisahan senyawa senyawa dengan menggunakan metode perebusan. Distilasi memiliki keuntungan memisahkan pelarut dari larutan. Cara paling sederhana untuk melakukan ini adalah menaikkan suhu secara perlahan.
- Proses memasak bisa dipersingkat dengan menambahkan garam saat makanan direbus airnya.
3. Depresi Titik Beku
Manfaat berikut akan diperoleh dari penurunan titik beku:
- Pada radiator mobil, Anda dapat membuat antibeku dengan menambahkan cairan yang tidak membeku, seperti etilen glikol.
- Taburi jalan raya menggunakan campuran garam CaCl2 dan NaCl yang bertujuan untuk mencairkan salju di jalan raya.
4. Tekanan osmotik
Tekanan osmotik dapat diterapkan dalam kehidupan sehari-hari sebagai berikut:
- Digunakan pada mesin cuci darah untuk pasien gagal ginjal, metode kerja yang digunakan adalah mesin cuci darah.
- Taburkan garam meja pada lintah yang sedang tumbuh untuk membasmi lintah.
- Dapat digunakan untuk mengontrol sel agar tidak rusak atau pecah.
Sifat koligatif larutan merupakan salah satu bahan kimia yang banyak diaplikasikan dalam kehidupan sehari-hari. Hal ini dibuktikan dengan banyaknya manfaat sifat koligatif yang ada pada suatu larutan untuk kehidupan nyata.
Baca Juga Artikel Lainnya :