Konfigurasi elektron merupakan materi yang pasti akan ditemui dalam mata pelajaran kimia. Maka materi ini harus dipelajari dengan baik agar dapat dipahami dan juga dipahami, karena materi ini merupakan salah satu materi dasar dalam kimia.
Jadi jika sudah menguasai materi dasar, maka lanjut ke materi selanjutnya bisa lebih mudah. Jadi kimia bisa jadi pelajaran yang menyenangkan karena kamu bisa mengikuti setiap materi yang disajikan dengan baik.
Ada beberapa hal penting yang harus diketahui untuk dapat memahami materi ini, yaitu langkah pertama adalah mengetahui dan memahami maknanya. Setelah itu baru bisa dilanjutkan ke materi yang lebih dalam seperti jenisnya dan sebagainya.
Arti dari Konfigurasi elektron
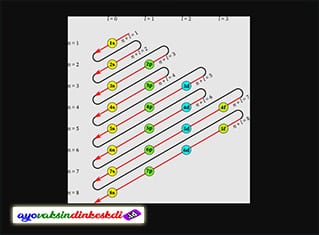
Konfigurasi elektron adalah susunan elektron dalam atom. Susunan elektron ini didasarkan pada kulit atau orbital atom. Pada dasarnya elektron adalah partikel yang bermuatan negatif dan berputar mengelilingi inti atom.
Gambaran yang lebih jelas dapat dianalogikan sebagai berikut, yaitu inti atom seperti matahari dan planet-planet yang bergerak mengelilingi matahari diibaratkan elektron.
Tujuan mempelajari berdasarkan orbital ini adalah untuk mempelajari sifat-sifat zat kimia. Selain itu, Anda juga dapat mengetahui periode dan juga golongan suatu atom.
Cara menentukannya adalah periode atom ditunjukkan dengan nomor kulit terbesar pada kulit elektron, atau pada kulit terluar. Sedangkan untuk golongan atom ditunjukkan dengan jumlah elektron di luarnya atau disebut dengan elektron valensi.
Ada dua cara untuk menentukan konfigurasi elektron, yang pertama adalah dengan jumlah elektron yang ada di setiap kulit atom (metode K, L, M, N), metode ini digunakan untuk atom yang termasuk dalam kelompok unsur IA-VIIIA .
Metode kedua dapat didasarkan pada jumlah elektron yang terdapat pada subkulit atom (metode s, p, d, f), metode ini dapat digunakan untuk atom-atom dalam unsur transisi atau golongan B.
Jenis dari Konfigurasi elektron
Ada dua jenis yang wajib diketahui, berikut penjelasan lengkapnya:
1. Konfigurasi kulit elektron
Jenis konfigurasi ini ditemukan oleh seorang ahli kimia bernama Niels Bohr. Ini juga yang membuat jenis konfigurasi ini disebut juga konfigurasi elektron bohr.
Dijelaskan di dalamnya bahwa elektron akan bergerak mengelilingi inti atom dalam lintasan tertentu, dengan tingkat energi yang bergantung pada posisi lintasan masing-masing, sehingga energinya juga akan berbeda. Lintasan ini dikenal sebagai kulit atom.
Teori ini juga menjelaskan bahwa konfigurasi elektron adalah pengisian elektron dimulai dari tingkat energi atau kulit yang paling rendah. Urutan pengisian adalah untuk kulit pertama dimulai dari kulit K (n = 1), L (n = 2), M (n = 3), N (n = 4) dan seterusnya.
Jumlah maksimum elektron yang dapat ditempati pada setiap kulit elektron, dapat dicari dengan menggunakan rumus 2.n2salah satu contohnya adalah sebagai berikut:
- Pada kulit K jumlah elektron yang dapat ditampung adalah 2.12 = 2
- Pada kulit L jumlah elektron yang dapat ditampung adalah 2,22 = 8
- Pada kulit M jumlah elektron yang dapat ditampung adalah 2,32 = 18
- Pada kulit N jumlah elektron yang dapat ditampung adalah 2,42 = 32, dst.
Contoh penerapannya adalah sebagai berikut:
Ca merupakan unsur yang memiliki nomor atom 20, karena Ca bukan atom yang tidak bermuatan, maka jumlah elektron Ca adalah 20 (nomor atom = jumlah elektron). Oleh karena itu konfigurasi dari 20Ca = 2,8,8,2.
2. Konfigurasi elektron subkulit
Jenis konfigurasi ini memiliki sifat yang lebih kompleks dibandingkan dengan jenis sebelumnya. Jenis konfigurasi ini menekankan probabilitas yang dapat ditemukan pada elektron, hal ini terjadi pada tingkat subkulit atom.
Pada tingkat subkulit, ia juga mengandung sebuah orbital yang merupakan tempat yang memungkinkan bagi sebuah elektron. Orbital ini terbagi menjadi empat yaitu ada orbital s, p, d dan juga f.
Pada konfigurasi subkulit ini akan melibatkan bilangan kuantum di dalamnya, berikut penjelasannya:
A. Bilangan kuantum utama
Bilangan kuantum utama juga dapat direpresentasikan menggunakan ‘n’. Bilangan kuantum utama mewakili tingkat energi utama elektron dalam atom, atau dapat digunakan untuk menunjukkan kulit atom.
Jadi bisa dibilang kuantum utama adalah gambaran lintasan elektron. Di dalam bilangan kuantum utama ini terdapat beberapa jenis kulit, antara lain K, L, M, N dan seterusnya.
Pada bilangan ini kulit pertama akan dilambangkan dengan K dimana nilai n = 1, nilai n akan bertambah 1 setiap bertambahnya kulit. Jadi pada L nilai n = 2, pada L nilai n = 3, pada N nilai n = 4 dan seterusnya.
Nilai bilangan kuantum utama harus dalam bentuk positif, dan nilainya sama dengan atau bisa lebih dari satu. Nilai yang dihasilkan tidak mungkin kembali ke nol atau bahkan ke bentuk negatif.
Dapat juga disimpulkan bahwa angka ini merupakan indikator jarak terjauh antara inti dan elektron. Jadi semakin besar nilai n dapat berarti energi dan ukuran orbit juga semakin besar.
B. Bilangan kuantum azimuth
Angka ini dilambangkan dengan ‘l’ atau ‘ℓ’, yang dapat digunakan untuk menyatakan bentuk orbital atau subkulit atom. Nilai angka ini menunjukkan subkulit s, p, d atau f.
Penentuan nilai dimulai dari l = 0 pada subkulit s, nilai l = 1 pada subkulit p, nilai l = 2 pada subkulit d, dan nilai l = 3 pada subkulit f. Contoh penerapannya dapat dilihat pada tabel di bawah ini:
| Bilangan kuantum utama | Bilangan kuantum azimuth | Jumlah subkulit | subkulit |
|---|---|---|---|
| K (n=1) | 0 | 1 | 1 detik |
| L(n=2) | 0, 1 | 2 | 2s, 2p |
| M(n=3) | 0, 1, 2 | 3 | 3s, 3p, 3d |
| N(n=4) | 0, 1, 2, 3 | 4 | 4s, 4p, 4d, 4f |
C. Bilangan kuantum magnetik
Bilangan kuantum berikutnya bersifat magnetis yang dilambangkan dengan ‘m’. Angka kuantum ini menunjukkan posisi orbital dalam subkulit atom. Orbital sendiri merupakan tempat perpindahan elektron dalam atom, dimana pada setiap orbital akan diisi oleh sepasang elektron.
Nilai bilangan kuantum magnetik tergantung pada bilangan kuantum azimuth, yang memiliki rentang m = -l hingga +l.
Contoh bilangan kuantum magnetik adalah sebagai berikut:
- m = 0 (0), subkulit s
- m = 1(-1, 0, 1), subkulit p
- m = 2 (-2, -1, 0, 1, 2), subkulit d
- m = 3 (-3, -2, -1, 0, 1, 2, 3), subkulit f
D. Putar nomor kuantum
Bilangan kuantum terakhir adalah putaran, dilambangkan dengan ‘s’. Bilangan kuantum ini menunjukkan arah dan juga posisi putaran elektron pada sumbunya. Cara mengungkapkan ini juga bisa menggunakan simbol panah ke atas atau ke bawah.
Arah putaran elektron hanya memiliki dua kemungkinan, yaitu searah jarum jam atau berlawanan arah jarum jam. Selain itu, nilai ‘s’ juga hanya dapat dinyatakan dengan ‘-½’ atau ‘+ ½’.
Jika nilainya negatif, berarti arah putarannya berlawanan arah jarum jam, sehingga dapat dilambangkan dengan simbol panah yang mengarah ke bawah (↓), sedangkan jika nilainya positif, searah jarum jam dan dilambangkan dengan panah yang mengarah ke atas (↑ ).
Uraian keempat bilangan kuantum pada diagram orbit dinyatakan sebagai berikut:
- s orbital = jumlah elektron maksimum yang dapat diisi adalah 2
- p orbital = elektron maksimum yang dapat diisi adalah 6
- d orbital = jumlah maksimum elektron yang dapat diisi adalah 10
- f orbital = jumlah maksimum elektron yang dapat diisi adalah 14
Aturan dan Prinsip di Konfigurasi elektron

Dalam memutuskan konfigurasi elektron sebuah atom tentunya harus memperhatikan kaidah dan prinsip yang ada. Berikut adalah penjelasan dari aturan dan prinsip tersebut:
1. Aturan Aufbau
Salah satu aturan internal yang paling banyak digunakan adalah aturan aufbau. Aturan ini menjelaskan pengisian orbital, jadi menurut prinsip ini pengisian elektron dimulai dari subkulit yang memiliki tingkat energi terendah hingga tertinggi.
Setiap subkulit memiliki batas maksimum pengisian elektron, seperti yang telah dijelaskan sebelumnya pada bilangan kuantum spin.
Setelah orbital yang tingkat energinya paling rendah terisi penuh, maka elektron dapat menempati orbital yang tingkat energinya lebih tinggi. Hal ini dilakukan terus sampai semua elektron dalam atom dapat menempati orbitnya.
2. Aturan Hund
Aturan ini dikemukakan oleh seorang ilmuwan bernama Friedrich Hund, oleh karena itu dinamai aturan Hund. Aturan ini menjelaskan bahwa elektron yang terkandung dalam orbital di subkulit cenderung tidak berpasangan.
Jadi orbital level yang menempati sublevel dengan energi yang sama, akan diisi oleh elektron satu per satu terlebih dahulu dengan arah putaran yang sama. Setelah semua ruang yang tersedia penuh, maka akan diisi dengan partner yang memiliki arah putaran berlawanan.
3. Pauli Ban
Penemu larangan Pauli adalah seorang ilmuwan bernama Wolfgang Pauli, yang menjelaskan bahwa dalam sebuah atom dengan nilai yang sama dari empat bilangan kuantum, tidak mungkin ada dua elektron.
Hal ini dikarenakan pada setiap orbital juga terdapat bilangan kuantum n, l, m, bedanya hanya pada spin atau s kuantumnya. Oleh karena itu setiap orbital hanya dapat diisi oleh 2 elektron dengan nilai bilangan kuantum spin yang berlawanan.
Jika elektron ketiga juga dimasukkan maka ada satu elektron sebelumnya dengan putaran yang sama
4. Aturan setengah penuh penuh
Aturan konfigurasi terakhir adalah ada yang penuh dan setengah penuh yang memiliki hubungan erat dengan hibridisasi elektron. Dalam aturan ini dijelaskan bahwa elektron lebih mungkin untuk berpindah orbital, jika dapat membentuk susunan elektron yang lebih stabil.
Konfigurasi elektron merupakan materi dasar dalam ilmu kimia yang penting untuk diketahui dan dipahami dengan baik. Caranya adalah dengan mengetahui dan memahami makna, jenis-jenis serta aturan dan prinsip di dalamnya.
Baca Juga Artikel Lainnya :
- Pengertian Fungsi Invers, Rumus, Komposisi, Contoh Soal Dll
- Cara Menghitung Persen di Excel, Kalkulator, Rumus, Contoh Soal
- Sel Tumbuhan dan Sel Hewan – Definisi, Struktur Dll. (Lengkap)
- Jumlah Dasar dan Jumlah Turunan Definisi dan Contoh
- Sifat Koligatif Larutan, Pengertian, Klasifikasi, Manfaat Dll
- Lokasi Astronomi Indonesia (Pembahasan Lengkap) Penting!!!
- Contoh Limit Fungsi Aljabar dan Jawabannya